CONTROLE DE QUALIDADE DE GEL DE ÁCIDO SALICÍLICO NUM CONTEXTO ACADÊMICO
QUALITY CONTROL OF SALICYLIC ACID GEL IN AN ACADEMIC CONTEXT
SANTOS Isabela Rigolin Bertussi Alves dos1; MARTINS, Adriana Aparecida1; SOUSA, Rafaella Rodrigues de1; SENA, Viviane Nascimento1; MORAIS, Jonatas Expedito Manguci de2; FRÓES, Bárbara Milani3; TESCAROLLO, Iara Lúcia4
1Estudantes do Curso de Farmácia da Universidade São Francisco (USF), Campinas, São Paulo, Brasil. 2 Farmacêutico e Técnico de Laboratório; 3Mestre em Ciências da Saúde, Docente do Curso de Farmácia, Orientadora Metodológica (USF). 4Doutora em Fármacos e Medicamentos, Docente do Curso de Farmácia, Orientadora Científica (USF).
isabela.bertussi@mail.usf.edu.br
Resumo: Aulas práticas permitem aprimorar as competências técnicas dos estudantes e ampliar a correlação entre a teoria e a prática. O controle de qualidade de produtos desenvolvidos em farmácias de manipulação chama atenção devido à relevância do assunto e impacto na saúde dos pacientes. O ácido salicílico é um fármaco de uso tópico que apresenta propriedades queratolíticas, sendo muito empregado no cuidado da acne vulgar. A incorporação do ácido salicílico em géis torna-se um desafio farmacotécnico em virtude de suas características físico-químicas, como baixa solubilidade em meio aquoso. O objetivo deste estudo foi realizar o controle de qualidade de um gel contendo 1,0% de ácido salicílico, desenvolvido em laboratório de ensino farmacêutico. Foram realizados ensaios físico-químicos como identidade, aspecto, densidade, conteúdo, pH, teor e microbiológicos. Embora a amostra tenha sido aprovada nos testes de identidade, aspecto, densidade, conteúdo, pH e teor, apresentou problemas de precipitação durante o ensaio de centrifugação, sugerindo instabilidade física que pode comprometer a eficácia do produto. Os ensaios propostos demonstraram ser simples e fáceis de serem executados na prática, exigindo poucos recursos e apresentando boa reprodutibilidade. No entanto, a precipitação observada no gel ressalta a importância de ajustes na formulação para garantir a qualidade e eficácia. Este estudo contribui para a discussão sobre fatores que podem interferir na qualidade de produtos manipulados, destacando a importância do controle de qualidade rigoroso.
Palavras-chave: Controle de qualidade; ácido salicílico; ensino farmacêutico.
Abstract: Practical classes allow students to improve their technical skills and expand the correlation between theory and practice. The quality control of products developed in compounding pharmacies draws attention due to the relevance of the subject and its impact on patients' health. Salicylic acid is a topical drug that has keratolytic properties and is widely used to treat acne vulgaris. The incorporation of salicylic acid into gels becomes a pharmacotechnical challenge due to its physicochemical characteristics, such as low solubility in aqueous media. The objective of this study was to perform quality control of a gel containing 1.0% salicylic acid, developed in a pharmaceutical teaching laboratory. Physicochemical tests were carried out such as identity, appearance, density, content, pH, content and microbiological tests. Although the sample passed the identity, appearance, density, content, pH and content tests, it presented precipitation problems during the centrifugation test, suggesting physical instability that could compromise the product's effectiveness. The proposed tests proved to be simple and easy to carry out in practice, requiring few resources and showing good reproducibility. However, the precipitation observed in the gel highlights the importance of adjustments to the formulation to ensure quality and efficacy. This study contributes to the discussion about factors that can interfere with the quality of handled products, highlighting the importance of strict quality control.
Keywords: Quality control; salicylic acid; pharmaceutical education.
INTRODUÇÃO
Em laboratórios experimentais de ensino farmacêutico, a prática do controle de qualidade permite não apenas aprimorar as competências técnicas dos estudantes, mas também, promover uma compreensão ampliada da importância da qualidade em produtos farmacêuticos. Estudos indicam que a experiência prática no controle de qualidade contribui na formação de profissionais competentes e conscientes das responsabilidades éticas e regulatórias da profissão farmacêutica (TESCAROLLO; PINTO, 2023; BRASIL, 2017; DIAS et al., 2013).
Neste cenário, o controle de qualidade de produtos desenvolvidos em farmácias de manipulação torna-se um tema de grande relevância na área farmacêutica, principalmente devido ao impacto direto que essas preparações têm na saúde dos pacientes. O planejamento de aulas com abordagem de assuntos do cotidiano farmacêutico pode ser uma estratégia interessante de aproximação entre a teoria, a prática e a realidade profissional (TESCAROLLO; PINTO, 2023; SILVA et al., 2018; BARDI; TESCAROLLO, 2019).
No que tange ao controle de qualidade de produtos manipulados, destacam-se a Resolução da Diretoria Colegiada (RDC) nº 67/2007 e a RDC nº 87/2008, publicadas pela Agência Nacional de Vigilância Sanitária (ANVISA), onde estão estabelecidas as Boas Práticas de Manipulação em Farmácias (BPMF). As BPMF visam garantir a segurança, a eficácia e a qualidade dos produtos, padronizando processos para assegurar que os medicamentos magistrais atendam aos requisitos sanitários (BRASIL, 2007; BRASIL, 2008).
A implementação das BPMF minimiza riscos de contaminação, erros de dosagem e outras não conformidades que podem comprometer a segurança dos medicamentos. A qualidade dos insumos, as pesquisas e a capacitação contínua dos profissionais são fatores a serem considerados relevantes no setor magistral. O controle de qualidade deve incluir a verificação de aspectos físico-químicos e microbiológicos dos produtos manipulados, conforme as normativas da ANVISA, garantindo rastreabilidade e conformidade com as normas regulamentares. Portanto, o conhecimento sobre o assunto e a aderência às diretrizes estabelecidas pela ANVISA são relevantes no sentido de assegurar a qualidade dos produtos manipulados e devem fazer parte da formação profissional (GIL, 2007; BRASIL, 2007; BRASIL, 2008; TESCAROLLO et al., 2011; FERREIRA; BRANDÃO, 2018).
Experimentos simples, utilizando vidrarias, equipamentos e reagentes comumente encontrados em laboratórios de ensino, permitem a reprodução de práticas em diferentes contextos de infraestrutura. A exequibilidade, o tempo de aula e o tema gerador devem motivar e engajar os estudantes na participação, discussão dos conteúdos e resolução dos desafios (DIAS et al., 2013; SILVA et al., 2018; TESCAROLLO; PINTO, 2023).
A determinação da qualidade de produtos manipulados é de grande interesse no contexto farmacêutico. O ácido salicílico (Figura 1), classificado como beta-hidroxiácido, é um ativo lipossolúvel muito utilizado em produtos farmacêuticos tópicos e cosméticos devido às suas propriedades queratolíticas e comedolíticas, especialmente no tratamento da acne vulgar. Nas farmácias de manipulação, pode ser preparado em diversas formas farmacêuticas, como creme, loção, gel, sabonete e xampu e em cosméticos sua concentração é limitada (BRASIL, 2001; FERREIRA; BRANDÃO, 2018).
Segundo a RDC nº 67/2007 e a RDC nº 87/2008, a avaliação da qualidade desses produtos envolve a determinação de parâmetros como descrição, aspecto, caracteres organolépticos e pH (BRASIL, 2007; BRASIL, 2008). A garantia da qualidade do gel de ácido salicílico é importante devido a necessidade em preservar a eficácia terapêutica ao longo do tempo, minimizando a degradação do ativo e prevenindo contaminações microbianas.
Figura 1. Ácido salicílico.
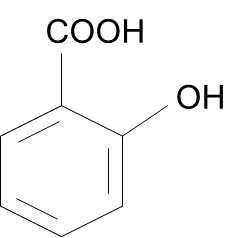
Fonte: Farmacopeia Brasileira (BRASIL, 2019).
Em relação ao uso tópico e propriedades terapêuticas, o ácido salicílico diminui a adesão dos corneócitos, causando afrouxamento e subsequente desprendimento dessas células. Devido perfil lipofílico, o ácido salicílico favorece a remoção de lipídeos intercelulares ligados covalentemente ao envelope corneificado das células epiteliais. Adicionalmente, é pertinente complementar que a coesão das células epidérmicas depende dos desmossomos que é formado por proteínas, dentre elas, a desmogleína, neste caso, o ácido salicílico interfere nessas proteínas levando à esfoliação (ARIF, 2015). No desenvolvimento de produtos tópicos, a solubilidade limitada do ácido salicílico em água, impõe desafios na formulação de géis homogêneos e estáveis. Várias formulações tópicas contendo ácido salicílico estão descritas no Formulário Nacional da Farmacopeia Brasileira em concentrações que variam de 1 a 20%, na forma de creme, loção, pomada, colódio, xampu e pasta, sendo indicadas no tratamento de hiperqueratoses (BRASIL, 2012; NARDIN, et al., 2013; PERES; DIAS, 2011).
Este estudo teve como objetivo realizar o controle de qualidade de gel de ácido salicílico a 1,0% em laboratório de ensino farmacêutico, seguindo compêndios oficiais e métodos adaptados. Como objetivos específicos buscou-se aplicar técnicas analíticas relativamente simples para verificar a conformidade do produto com as especificações farmacopeicas.
METODOLOGIA
Esta prática foi organizada em etapas e os experimentos foram realizados pelas equipes de estudantes durante a aula laboratorial dos componentes curriculares controle de qualidade físico-químico e controle de qualidade microbiológico do sétimo semestre do Curso de Farmácia da Universidade São Francisco, Campinas, SP, Brasil. Foram empregados ensaios utilizando como referência a Farmacopeia Americana - United States Pharmacopeia - (USP, 2005), a Farmacopeia Brasileira (BRASIL, 2019) e métodos alternativos (MOUSSAVOU; DUTRA, 2012).
Gel de ácido salicílico a 1,0%
O gel de ácido salicílico a 1,0% foi manipulado no Laboratório de Farmacotécnica. O produto foi preparado empregando-se: 1,0% de ácido salicílico como princípio-ativo; 2,0% de hidroxietilcelulose como polímero formador de gel, 5,0% de glicerina como umectante; 0,1% de metilparabeno como conservante, 10,0% de etanol como solvente e água purificada para completar 100,0%. No protocolo farmacotécnico, o ácido salicílico foi disperso no álcool, depois na glicerina e, em seguida, incorporado ao gel, de acordo com adaptações da fórmula proposta no Formulário Nacional da Farmacopeia Brasileira (BRASIL, 2012). O gel foi envasado em potes plásticos, opacos, boca larga e tampa rosca com capacidade para 30 g, sendo encaminhado para o Laboratório de Controle de Qualidade, para realização das análises. Foram estabelecidas as especificações farmacotécnicas durante o desenvolvimento do produto (FERREIRA, BRANDÃO, 2018).
Integridade da amostra
Foram observadas informações importantes impressas no rótulo, integridade das embalagens e os dados impressos como nome do produto manipulado, concentração, data de preparo, data de validade, ordem de produção e demais descrições.
Aspecto
Para a determinação do aspecto, quantidade equivalente a 10 g, foi transferida para vidro relógio, sendo realizada a observação visual. A amostra deve se apresentar como gel translúcido, homogêneo, com brilho, isento de partículas insolúveis (MOUSSAVOU; DUTRA, 2012).
Sensação tátil
Cerca de 1,0 g da amostra foi aplicada e friccionada no dorso da mão, depois desta ter sido lavada e seca. Os resultados foram registrados de acordo com as características sensoriais: áspero; pegajoso; liso; evanescente (MOUSSAVOU; DUTRA, 2012).
Odor
Quantidade equivalente a 1,0 g, foi transferida para vidro relógio, com objetivo de avaliar o odor. Os resultados foram registrados de acordo com as características sensoriais: desagradável; pouco agradável; moderadamente agradável; agradável; muito agradável; inodoro (MOUSSAVOU; DUTRA, 2012).
Identidade
O ensaio de identidade foi adaptado da Farmacopeia Americana (USP, 2005). Cerca de 5,0 g da amostra foi dispersa em 10 mL de água destilada e, em seguida, transferida para tubo de ensaio, onde foram incorporadas gotas de cloreto férrico SR. Conforme especificação farmacopeica a produção de cor violeta indica a presença de ácido salicílico. Para o teste de identidade alternativo (PAZINATO et al., 2012), cerca de 1,0 g da amostra foi transferida para um béquer onde foram adicionados 10 mL de água destilada, permanecendo em repouso por 30 minutos, com agitação intermitente. Após esse período, foram incorporados 5,0 mL de solução de bicarbonato de sódio 1M. Segundo a especificação do método alternativo, a produção de bolhas indica a presença de ácido salicílico.
Determinação do conteúdo
A determinação do conteúdo envolveu a inspeção do rótulo para a observação do peso nominal. Para este estudo foram separadas 10 unidades, as mesmas foram pesadas anotando-se a massa. Em seguida o conteúdo foi cuidadosamente removido do pote e reservado. Os potes vazios foram lavados com água e etanol, secos em estufa e, após o resfriamento, as tampas foram recolocadas e o conjunto pesado novamente. O peso do conteúdo (g) foi calculado com base na diferença entre as duas pesagens. Segundo dados farmacopeicos, o peso médio dos conteúdos não é inferior ao peso declarado e o peso individual das unidades testadas não pode ser inferior a 90,0% em relação ao peso declarado. Caso não seja cumprida essa exigência, é recomendado testar mais 20 unidades (BRASIL, 2019).
Densidade
O ensaio foi realizado em picnômetro de metal, específico para formas farmacêuticas semissólidas, com capacidade para 25 mL. O picnômetro foi pesado (m1). Em seguida, a amostra foi transferida para o picnômetro, o conjunto foi pesado (m2) novamente. A partir das massas obtidas, a densidade (d) foi calculada pela fórmula: d = m2-m1/Volume. O resultado foi expresso em g/mL considerando uma faixa de 0,980 a 1,020 g/mL, estabelecida durante o desenvolvimento farmacotécnico do produto (MOUSSAVOU; DUTRA, 2012).
Determinação do pH
Para a determinação do pH a amostra foi diluída transferindo-se 5,0 g para béquer contendo 50,0 mL de água destilada. O pH foi obtido a partir do potenciômetro de bancada calibrado e acoplado a eletrodo de vidro e termorregulador. O eletrodo limpo e seco foi mergulhado diretamente na amostra em solução. O ensaio foi realizado em triplicata (BRASIL, 2019).
Teste de centrifugação
Aproximadamente 5,0 g da amostra foi centrifugada a 3000 rpm por 30 minutos sob temperatura de 25ºC. Em seguida, sinais de afloramento, precipitação, exsudação (perda de água), sedimentação ou separação de fases foram avaliados visualmente. O produto deve ser isento de partículas sedimentadas (MOUSSAVOU; DUTRA, 2012).
Doseamento
O doseamento do ácido salicílico foi efetuado por volumetria de neutralização conforme descrito na Farmacopeia Americana (USP, 2005). Foram transferidos 10,0 g da amostra do gel para erlenmeyer contendo 25,0 mL de etanol, 20,0 mL de água destilada e 0,1 mL de solução indicadora de fenolftaleína. A amostra foi titulada com solução fatorada de hidróxido de sódio 0,1 mol.L-1. Os cálculos foram baseados no fator titulométrico farmacopeico: cada 1mL de NaOH 0,1 mol.L-1 equivale a 13,8123 mg de ácido salicílico. O teor do ativo foi calculado considerando-se o volume gasto na prova do branco. Conforme especificação farmacopeica, o gel deve apresentar, no mínimo, 90,0% e máximo de 110,0% de ácido salicílico.
Contagem do número total de microrganismos mesofílicos
Para a realização de ensaios microbiológicos em produtos não estéreis, é relevante empregar técnicas assépticas tanto na coleta de amostras quanto na execução dos testes. De acordo com a Farmacopeia Brasileira, foram transferidos 10 mL da amostra para 90 mL de solução tampão, realizando uma diluição de 1/10. Alíquota de 0,1 mL foi diluída na superfície de cada meio de cultura. Realizou-se a semeadura utilizando o método de espalhamento em placa (Spread-Plate), com o auxílio de uma Alça de Drigalski. As placas com Ágar caseína-soja foram incubadas a uma temperatura de 32,5 ± 2,5°C por um período de três a cinco dias, e as placas com Ágar Sabouraud-dextrose a 22,5 ± 2,5°C por cinco a sete dias, para determinar o número total de microrganismos aeróbios, bolores e leveduras, respectivamente. A média aritmética das contagens das placas de cada meio foi calculada para determinar o número de unidades formadoras de colônias (UFC) por grama ou mililitro do produto. O limite microbiano para produtos tópicos é de até 102 UFC/g ou mL, contagem total de fungos até 101 UFC/g ou mL e ausência de Staphylococcus aureus, Pseudomonas aeruginosa ou qualquer microrganismo patogênico (BRASIL, 2019).
Microrganismos patogênicos
Para identificar a presença ou ausência de microrganismos patogênicos foi utilizado o meio de cultura seletivo MacConkey. Os procedimentos experimentais incluíram etapas de pré-enriquecimento para assegurar a recuperação dos microrganismos, caso estejam presentes no produto. Inicialmente preparou-se a amostra, utilizando uma diluição de 1:10, com no mínimo 1,0 g do produto a ser examinado, seguindo os procedimentos descritos na Farmacopeia Brasileira. Alíquota de 10 mL da diluição de 1:10 foi transferida para 90 mL de caldo de enriquecimento (Caldo caseína-soja) ou uma quantidade equivalente a 1 g ou 1 mL do produto. Após homogeneização, o material foi incubado sob 32,5 ± 2,5 °C por 18 a 24 horas. Transferiu-se 1 mL da amostra enriquecida para 100 mL de Ágar MacConkey, seguindo com incubação a 43 ± 1 °C por 24 a 48 horas. Conforme especificação da Farmacopeia Brasileira, o crescimento de colônias vermelhas, geralmente não mucosas, com morfologia característica de bacilos Gram-negativos, indica a provável presença de Escherichia coli. O resultado deve cumprir os requisitos microbiológicos estabelecidos (BRASIL, 2019).
RESULTADOS E DISCUSSÃO
A determinação do aspecto teve como objetivo avaliar as características do gel de ácido salicílico a 1,0% (Figura 2). No rótulo estavam apenas os dizeres referentes ao nome do produto, concentração, peso, data de fabricação, data de validade e responsável pela manipulação. Por se tratar de uma amostra extemporânea produzida para fins didáticos, não foram encontradas as informações exigidas pela RDC n. 67/2007 e BPMF (BRASIL, 2007). O gel apresentou brilho, porém, com visível presença de partículas insolúveis estando fora dos critérios determinados no desenvolvimento farmacotécnico. Esta observação pode ser explicada pela dificuldade em solubilizar o ácido salicílico que se apresenta na forma de cristais pouco solúveis em água (2 g/L a 20°C). A presença de partículas insolúveis sugere que a técnica de solubilização utilizada não foi eficiente. A literatura recomenda o uso de solventes mistos para melhorar a solubilização de compostos pouco solúveis em meio aquoso, como é o caso do ácido salicílico (SADEGHI; RASMUSON, 2020).
Quanto à sensação tátil, o gel de ácido salicílico a 1,0% se apresentou levemente pegajoso, estando em conformidade com o esperado. O odor foi caracterizado como agradável, com leve característica acética.
Figura 2. (A) Amostra do gel de ácido salicílico a 1,0%, disponibilizada em potes plásticos. (B) Aspecto do gel com visível presença de cristalização.

Fonte: Elaborado pelos autores.
O ensaio de identidade teve como propósito verificar se o medicamento manipulado continha o ácido salicílico em sua formulação. Esta análise permite detectar falsificações e assegurar o tratamento adequado. Os métodos mais comuns recomendados pelas farmacopeias incluem técnicas clássicas baseadas em reações químicas e métodos instrumentais como a espectrofotometria UV-Vis e a Cromatografia Líquida de Alta Eficiência (CLAE). Esses métodos são escolhidos levando-se em conta múltiplos fatores como a natureza do fármaco em questão e a matriz do medicamento (GIL, 2007). Um parâmetro relevante para este tipo de teste é a seletividade, ou seja, capacidade em identificar analito de interesse mesmo estando presente numa amostra complexa.
A Farmacopeia Americana (USP, 2005) recomenda apenas o ensaio baseado na reação química entre o ácido salicílico previamente dissolvido e o cloreto férrico diluído. Apesar do método ser simples e reprodutível em laboratórios de ensino farmacêutico, a reação não é seletiva, uma vez que o cloreto férrico é capaz de formar complexos coloridos com compostos que apresentem hidroxila fenólica em sua molécula, como observado por Pazinato et al. (2012). Mesmo assim, o resultado obtido permitiu identificar o ácido salicílico na amostra de gel como observado na Figura 3, que também apresenta a reação envolvida.
Figura 3. (A) Prova do branco; (B) Resultado positivo para o ensaio de identidade do ácido salicílico por reação química; (C) Reação entre o ácido salicílico e o cloreto férrico formando um complexo colorido.
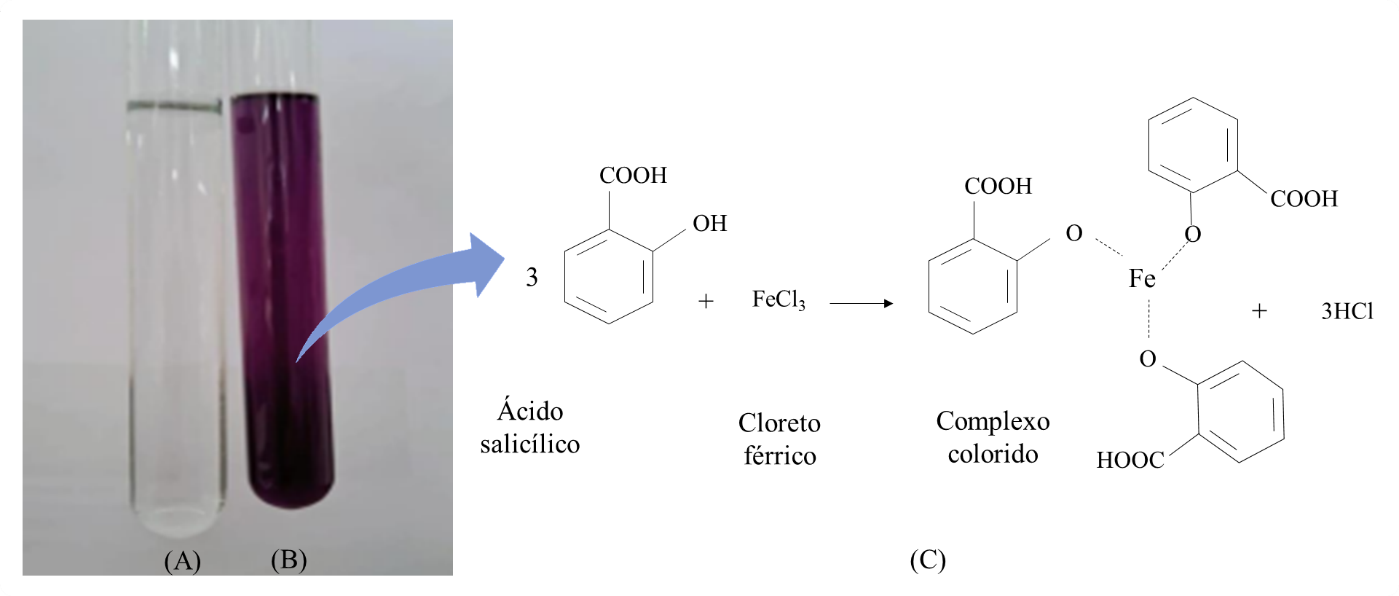
Fonte: Elaborado pelos autores.
Um método alternativo foi proposto devido o fato do ácido salicílico apresentar um grupo carboxila ácido. Uma das formas de identificar ácidos carboxílicos é mediante a reação com bicarbonato de sódio, onde ocorre a formação de sal, água e o desprendimento de gás carbônico. Este último permite a visualização da ocorrência da reação (Figura 4). Trata-se de outro método simples e reprodutível em laboratórios de ensino farmacêutico, porém, o bicarbonato de sódio é capaz de reagir, da mesma forma, com outros compostos que apresentem grupo carboxila ácido em sua molécula (PAZINATO et al., 2012).
Figura 4. (A) Resultado positivo para o ensaio de identidade do ácido salicílico por reação química; (B) Reação entre o ácido salicílico e o bicarbonato de sódio formando bolhas.
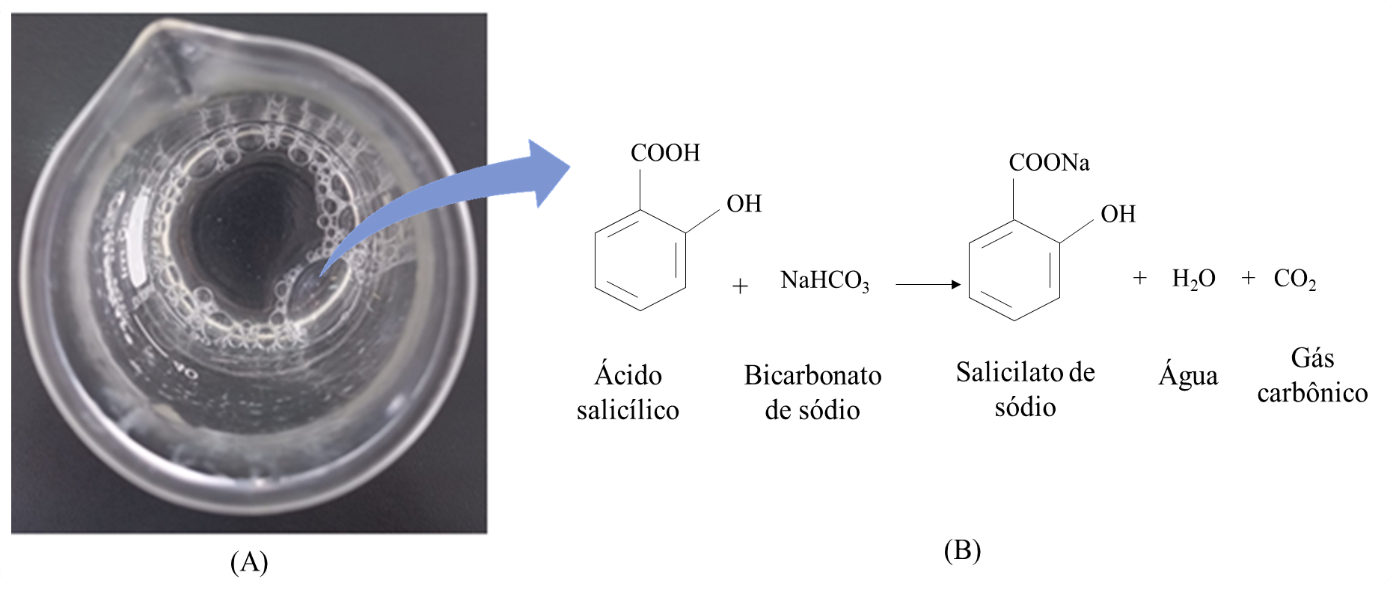
Fonte: Elaborado pelos autores.
O conteúdo de cada unidade foi determinado e, como pode ser observado na Tabela 1, o peso individual de nenhuma das unidades testadas foi inferior a 95,0% ou superior a 110,0 % do total declarado. A porcentagem do conteúdo médio encontrado foi 99,41 g ± 1,79, portanto, atende ao ensaio conforme a Farmacopeia Brasileira (BRASIL, 2019), indicando que o processo de enchimento foi adequado.
Tabela 1. Resultados do ensaio de determinação do conteúdo.
|
Amostras |
Potes cheios (g) |
Potes vazios (g) |
Conteúdo (g) |
% |
|
1 |
46,01 |
16,02 |
29,99 |
99,96 |
|
2 |
46,20 |
15,85 |
30,35 |
101,17 |
|
3 |
48,28 |
17,91 |
30,18 |
100,60 |
|
4 |
45,67 |
17,02 |
28,64 |
95,48 |
|
5 |
46,26 |
16,19 |
30,07 |
100,24 |
|
6 |
44,58 |
17,44 |
29,14 |
97,13 |
|
7 |
46,62 |
16,99 |
29,63 |
98,78 |
|
8 |
47,99 |
17,90 |
30,09 |
100,30 |
|
9 |
46,00 |
16,00 |
30,00 |
99,99 |
|
10 |
47,24 |
17,10 |
30,14 |
100,48 |
|
Média |
46,49 |
16,84 |
29,82 |
99,41 |
|
Desvio-Padrão |
1,11 |
0,78 |
0,54 |
1,79 |
Fonte: Elaborado pelos autores.
A densidade relaciona a massa com o volume (MOUSSAVOU; DUTRA, 2012; FERREIRA, BRANDÃO, 2018). A monografia do ácido salicílico gel não estabelece este ensaio, portanto, o mesmo é considerado não farmacopeico (USP, 2005). Para o gel de ácido salicílico utilizado neste estudo, a densidade foi determinada em triplicata tendo como resultado d= 1,00764 g/mL.
A importância da determinação da densidade de produtos semissólidos reside no fato de que este atributo tem relação com a embalagem, principalmente quando o conteúdo é declarado em gramas. Produtos como géis, cremes e pomadas, com densidade abaixo da faixa estabelecida no desenvolvimento farmacotécnico, podem ter um volume maior e peso menor, o que pode impactar no processo de enchimento e envase.
Neste estudo, o gel de ácido salicílico foi envasado em potes com capacidade de 30g, logo, considerando sua densidade prática (1,00764 g/mL), e a fórmula da densidade (d=m/v), o volume ocupado por 30g da amostra será 29,77 mL, estando compatível com a capacidade da embalagem. A densidade do produto está dentro da faixa estabelecida (0,9800 a 1,020 g/mL), assim sendo, o resultado foi considerado satisfatório. É importante ressaltar que a incorporação de ar durante a manipulação e envase dos produtos representa um artefato técnico que pode interferir na densidade final.
O pH da de produtos semissólidos é um atributo crítico, pois pode afetar a estabilidade e a eficácia do ativo e deve permanecer num intervalo aceitável para cada tipo de forma farmacêutica. O pH também deve ser compatível com o local de aplicação e finalidade terapêutica. Neste estudo, o pH encontrado foi 3,40 ± 0,02, este resultado está de acordo com a
literatura, que indica maior eficácia do ácido salicílico em pH ácido, embora isso possa aumentar o risco de irritação cutânea (REHIN et al., 2004; PERES; DIAS, 2011). Produtos mais ácidos que a pele, devem seguir rigorosos critérios de indicação (REHIN et al., 2004; PERES; DIAS; 2011; MELO; CAMPOS, 2016). Para cosméticos contendo ácido salicílico, a Câmara Técnica de Cosméticos (CATEC) recomenda a concentração máxima de 10,0% e pH superior a 3,5%, além de incluir recomendações durante aplicação na pele, precauções na rotulagem do produto e classificação como Grau II (BRASIL, 2001).
O ensaio de centrifugação simula um aumento de força de gravidade levando a amostra ao estresse físico e tem como objetivo antecipar possíveis instabilidades do sistema que podem se apresentar na forma de separação de fases, precipitação entre outros fenômenos (MOUSSAVOU; DUTRA, 2012). Após o teste de centrifuga a amostra apresentou sinais de precipitação, justificado devido o ácido salicílico não ter sido totalmente solubilizado antes da incorporação ao gel (SADEGHI; RASMUSON, 2020). Esta não conformidade precisa ser ajustada no desenvolvimento farmacotécnico do produto, testando-se misturas binárias de diferentes solventes que favoreçam a solubilização do ativo e estabilização do sistema em gel.
O teor refere-se à quantidade do fármaco presente no produto. Este ensaio busca determinar o teor do ativo na amostra a fim de garantir a dose correta do medicamento, mesmo para aqueles que são aplicados topicamente. O doseamento foi realizado conforme o método descrito na Farmacopeia Americana (USP, 2005). A especificação farmacopeica para o teor de ácido salicílico no gel é de no mínimo 90,0% e no máximo 110,0% da quantidade declarada. O resultado das análises em triplicata indica que o produto está de acordo com o especificado (Tabela 2).
Tabela 2. Resultados do doseamento.
|
Amostra do gel (g) |
Volume (mL) NaOH 0,1 mol.L-1; fc: 0,9980 |
Valor de ácido salicílico encontrado (g) |
Teor (%) |
|
10,14 |
7,7 |
0,1064 |
95,35 |
|
10,01 |
7,5 |
0,1036 |
96,61 |
|
10,75 |
7,8 |
0,1077 |
99,80 |
|
Média |
|
97,25 |
|
|
Desvio-Padrão |
|
2,29 |
|
Fonte: Elaborado pelos autores.
A contagem de microrganismos foi realizada para avaliar contaminação microbiana. Placas de ágar foram inoculadas com a amostra e incubadas para permitir possível crescimento de microrganismos presentes. A contagem do número total de microrganismos mesofílicos está prevista na Farmacopeia Brasileira onde estão relacionados os limites específicos a fim de garantir a segurança na aplicação do produto. Qualquer desvio deve ser investigado e corrigido antes que o lote seja liberado para uso (BRASIL, 2019).
Ao analisar o resultado do controle de qualidade microbiológico do gel de ácido salicílico em Ágar caseína-soja, Ágar-Sabouraud e Ágar MacConkey, foi possível concluir que não houve crescimento de microrganismos (Figura 5). A presença do conservante metilparabeno pode ter contribuído para este resultado, aumentando a estabilidade microbiológica do produto (BRASIL, 2019).
Figura 5. Resultados do controle de qualidade microbiológico.
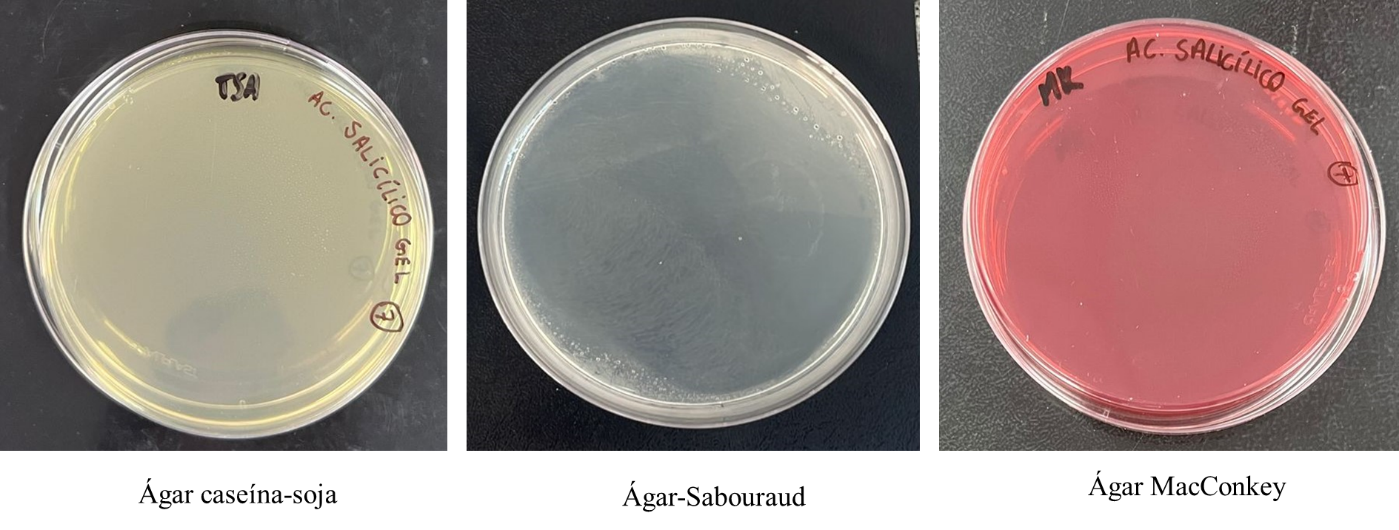
Fonte: Elaborado pelos autores.
Este estudo apresentou uma proposta para o controle de qualidade de gel de ácido salicílico a 1,0% em laboratório de ensino farmacêutico, seguindo compêndios oficiais e métodos adaptados, visando o emprego de técnicas analíticas simples, para verificar a conformidade do produto com as especificações farmacopeicas. Os ensaios propostos foram considerados fáceis de serem executados, exigindo poucos recursos e com boa resolutividade e reprodutibilidade já que foi desenvolvido paralelamente entre as diferentes equipes de estudantes. O roteiro aqui apresentado pode ser implementado em aulas práticas de controle de qualidade físico-químico e microbiológico. O gel de ácido salicílico a 1,0% apresentou algumas não conformidades passíveis de serem discutidas, pelo fato de ter sido desenvolvido em laboratório de aulas práticas e que muitas vezes não reúne as condições favoráveis para a reprodução das BPMF. Os resultados práticos permitiram levantar importantes discussões dos fatores que podem interferir na qualidade de produtos manipulados, enriquecendo a abordagem dos conteúdos teóricos.
CONCLUSÃO
Diante das condições experimentais deste estudo, conclui-se que foi possível propor um controle de qualidade de gel de ácido salicílico a 1,0% em laboratório de ensino farmacêutico, seguindo compêndios oficiais e métodos adaptados. As técnicas analíticas utilizadas para verificar a conformidade do produto com as especificações farmacopeicas foram consideradas simples e exequíveis dentro da infraestrutura laboratorial disponível. Foram realizados ensaios físico-químicos e microbiológicos, incluindo determinação do aspecto, propriedades organolépticas, identidade, conteúdo, densidade, peso, centrifugação, pH, doseamento e segurança biológica por meio da contagem do número total de microrganismos mesofílicos e investigação de microrganismos patogênicos. Os principais achados revelaram a presença de partículas insolúveis devido à baixa solubilidade do ácido salicílico, indicando a necessidade de revisão dos procedimentos de solubilização. Apesar de algumas não conformidades, como a solubilidade inadequada, outros parâmetros como densidade e pH estavam dentro das especificações aceitáveis. Os resultados práticos deste estudo são passíveis de serem discutidos e permitem novas pesquisas que possam contribuir para o desenvolvimento farmacotécnico, visando a melhoria da qualidade físico-química e microbiológica do produto. Este estudo destaca a importância de ajustes metodológicos e a necessidade de procedimentos rigorosos de controle de qualidade em laboratórios de ensino farmacêutico, contribuindo para a formação de profissionais competentes e preparados para enfrentar desafios na manipulação de produtos farmacêuticos.
REFERÊNCIAS
ARIF, T. Salicylic acid as a peeling agent: a comprehensive review. Clinical, cosmetic and investigational dermatology, p. 455-461, 2015.
BARDI, M.A.; TESCAROLLO, I.L. Aprendizagem ativa: trajetórias para inovação no ensino em saúde. In: ANDREASSA JUNIOR, Gilberto et al. (org.). Aprendizagem ativa: métodos e desafios na educação superior. Curitiba: Editora Íthala, 2019. p. 169-186.
BRASIL. Ministério da Educação. Conselho Nacional de Educação. Câmara de Educação Superior. Resolução CNE/CES nº 6, de 19 de outubro de 2017. Institui Diretrizes Curriculares Nacionais do Curso de Graduação em Farmácia. Diário Oficial da União. Brasília, DF, 2017.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Farmacopeia Brasileira. 6.ed. Volumes 1 e 2. Brasília: Anvisa, 2019.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Formulário nacional da farmacopeia brasileira. 2.ed. Brasília: Anvisa, 2012. 224 p. Revisão 02. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/formulario-nacional/arquivos/8065json-file-1. Acesso em: 2 ago. 2024.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Utilização de alfa-hidroxiácidos em produtos cosméticos. Parecer técnico n. 7, de 28 de setembro de 2021.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada nº 67, de 08 de outubro de 2007. Dispõe sobre o regulamento técnico de Boas Práticas de Manipulação de Preparações Magistrais para Uso Humano em Farmácias. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 2007.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada nº 87, de 21 de novembro de 2008. Altera o Regulamento Técnico sobre as Boas Práticas de Manipulação de Medicamentos em Farmácias. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 2008.
DIAS, I.L.T. et al. Estratégias de ensino em farmácia. Integração desenvolvimento farmacotécnico e análise da qualidade. Infarma - Ciências Farmacêuticas, [S.l.], v. 21, n. 1/2, p. 56-59, jan. 2013. ISSN 2318-9312. Disponível em: <https://revistas.cff.org.br/?journal=infarma&page=article&op=view&path%5B%5D=174&path%5B%5D=164>. Acesso em: 12 de jul. 2024.
FERREIRA A.O.; BRANDÃO M. Guia Prático da Farmácia Magistral. 5ª ed., São Paulo: Pharmabooks Editora, 2018.
GIL, E. S. et al. Controle físico-químico de qualidade de medicamentos. São Paulo: Pharmabooks, v. 46, p. 103-104, 2007.
MELO, M. O.; CAMPOS, P. M. M. Função de barreira da pele e pH cutâneo. Cosmetics & Toiletries, v. 28, p. 5, 2016.
MOUSSAVOU, U. P. A.; DUTRA, V. C. Controle de qualidade de produtos cosméticos. Rede de tecnologia e inovação do Rio de Janeiro, REDETEC, 2012, 40p.
NARDIN, A. D. G.; CANDA, T. C. P. S. A.; TESCAROLLO, I. L. Produção de sabonete líquido de ácido salicílico empregando hidroxipropil guar como agente de viscosidade. Interbio, v.7, n.2, p. 23-32, 2013. Disponível em: https://www.unigran.br/dourados/revistas/interbio?trabalho=779. Acesso em: 23 de jul. 2024.
PAZINATO, M. S. et al. Uma abordagem diferenciada para o ensino de funções orgânicas através da temática medicamentos. Química Nova na Escola, v. 34, n. 1, p. 21-25, 2012.
PERES, L.P.A; DIAS, I.L.T. Desenvolvimento e avaliação de formulações em gel para veiculação de ácido salicílico. Revista Multidisciplinar d a Saúde, Ano III, n. 5, 2011, p. 26-36. Disponível em: https://revistas.anchieta.br/index.php/RevistaMultiSaude/article/view/924. Acesso em: 23 de jul. 2024.
RHEIN, L., CHAUDHURI, B.; JIVANI, N.; FARES, H.; DAVIS, A. Targeted delivery of salicylic acid from acne treatment products into and through skin: role of solution and ingredient properties and relationships to irritation. J Cosmet Sci. Jan-Feb, v. 55, n.1p. 65-80, 2004.
SADEGHI, M.; RASMUSON, Å.C. Solubility of salicylic acid, salicylamide, and fenofibrate in organic solvents at low temperatures. Journal of Chemical & Engineering Data, v. 65, n. 10, p. 4855-4861, 2020.
SILVA, L.F.; PARISE, M.C. P.; ARAÚJO, C.E.P.; TESCAROLLO, I. Sequência de ensino-aprendizagem em farmácia: metodologia ativa com o tema perfume. Revista Ensaios Pioneiros, v. 2, n. 1, p. 47–60, 2018. DOI: 10.24933/rep.v2i1.153. Disponível em: https://revistaensaiospioneiros.usf.edu.br/ensaios/article/view/153. Acesso em: 27 jul. 2024.
TESCAROLLO, I. L.; ALMEIDA, R. L. de B.; CARRIEIRO, E. F. Avaliação da qualidade de cápsulas de amoxicilina produzidas em farmácias magistrais. Revista Eletrônica de Farmácia, Goiânia, v. 8, n. 4, p. 14, 2011. DOI: 10.5216/ref.v8i4.16617. Disponível em: https://revistas.ufg.br/REF/article/view/16617. Acesso em: 2 ago. 2024.
TESCAROLLO, I. L.; PINTO, M. C. Análise da qualidade de medicamento à base de cloreto de sódio: proposta para aulas práticas de controle de qualidade físico-químico. Revista Ensaios Pioneiros, v. 6, n. 2, 2023. DOI: 10.24933/rep.v6i2.278. Disponível em: https://revistaensaiospioneiros.usf.edu.br/ensaios/article/view/278. Acesso em: 29 jul. 2024.
USP. United States Pharmacopeia, 29. National Formulary, 24. Salicylic acid gel. 2005. Disponível em: http://www.pharmacopeia.cn/v29240/usp29nf24s0_m74330.html . Acesso em: 01 de junho de 2024.
Recebido em: 28/08/2024
Publicado em: 04/09/2024
DOI: 10.24933/e-usf.v8i1.442